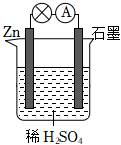
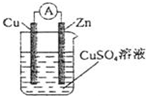
在盛有500mL 0.1mol/LCuSO4和0.4mol/LH2SO4混合溶液的大燒杯中.用鋅、銅作電極,用導(dǎo)線連接形成原電池,當(dāng)電極鋅消耗6.5g時(shí),試完成:
(1)寫出電極反應(yīng)式:負(fù)極Zn-2e-=Zn2+Zn-2e-=Zn2+;正極Cu2++2e-=Cu和2H++2e-=H2↑Cu2++2e-=Cu和2H++2e-=H2↑.
(2)電極上共析出氫氣的質(zhì)量.
【考點(diǎn)】原電池與電解池的綜合.
【答案】Zn-2e-=Zn2+;Cu2++2e-=Cu和2H++2e-=H2↑
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:22引用:1難度:0.3